Cómo diferenciar la reacción endotérmica de la exotérmica
Contenido del Artículo
- ¿Que necesitas para diferenciar la reacción endotérmica de la exotérmica?
- Reacción exotérmica
- Reacción endotérmica
- Instrucciones para diferenciar la reacción endotérmica de la exotérmica
- Experimento de reacción exotérmica
- Experimento de reacción endotérmica
- Diferencias
- Consejos para diferenciar la reacción endotérmica de la exotérmica
La termoquímica estudia todas las transformaciones que se presentan cuando en una reacción química ocurren variaciones en la energía calórica, es decir, si pierde o absorbe calor. Es por ello que decimos que en muchas reacciones químicas son más importantes los cambios energéticos que se presentan, que los productos que se obtienen.
Por ejemplo, las reacciones químicas de combustión en las estufas de gas y en los motores de combustión interna de los automóviles, en las cuales es más importante el calor obtenido que los productos de reacción. Recuerda que en los procesos de combustión se obtienen como producto el C02 y el agua, pero en este caso es más importante lo que obtenemos en la reacción calórica.
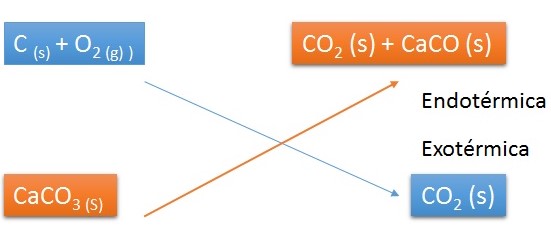
Durante una reacción química existe formación y rompimiento de enlaces. En la formación de enlaces se desprende calor, mientras que en el segundo caso es necesario aplicar calor.
Cuando la energía involucrada en la formación de los enlaces es mayor que la energía involucrada en el rompimiento de enlaces que se da en los reactivos se desprende calor se dice que la reacción es exotérmica. En el caso contrario, cuando es mayor la energía del rompimiento de los enlaces y menor la formación, se dice que la reacción es endotérmica.
Vamos a explicarlo de una manera más sencilla. Cuando la madera arde la energía del sistema disminuye liberando calor en el ambiente. Esa tendencia a alcanzar una energía más baja es una de las fuerzas que impulsan todas las reacciones químicas. Aquellas reacciones que liberan energía son conocidas como reacciones exotérmicas.
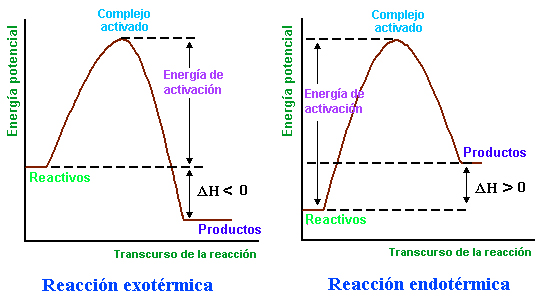
En una reacción exotérmica la energía de los reactantes es relativamente alta. Los productos de la reacción tienen una energía más baja. A medida que la reacción avanza hacia abajo desde energía alta hasta energía baja los reactantes son convertidos en productos y el sistema libera energía.
Casi todas las reacciones químicas tienden a liberar energía, generalmente en forma de calor. Por ejemplo, el automóvil está diseñado para liberar energía en forma de movimiento en la carretera y el calor es el del motor.
En las reacciones donde se absorbe la energía son las que se denominan reacciones endotérmicas. En una reacción endotérmica la reacción de los reactantes es relativamente baja y la de los productos, en cambio, es mayor. A medida que la reacción avanza desde energía baja hasta energía alta los reactantes son convertidos en productos. En este proceso la energía es absorbida.
Muchas reacciones importantes absorben energía, las plantas y animales no crecerían sin una reacción de energía. La reacción para la cocción de alimentos requiere de una absorción de energía, por lo tanto se trata de una reacción endotérmica.
Pero quizá las diferencias se vean mejor mediante un experimento práctico.
¿Que necesitas para diferenciar la reacción endotérmica de la exotérmica?
Reacción exotérmica
Reacción endotérmica
Instrucciones para diferenciar la reacción endotérmica de la exotérmica
Experimento de reacción exotérmica

Experimento de reacción endotérmica

Diferencias
Consejos para diferenciar la reacción endotérmica de la exotérmica

